Farmaci e salute
Cura e bellezza del corpo
Nutrizione e sport
Genitori e bambini
Igiene e trattamento
Casa
Marche
Promozioni
Dettagli
240 mg Vemurafenibum
,
Hypromellosi acetas succinas
,
Silica colloidalis anhydrica
,
Croscarmellosum natricum
,
Hydroxypropylcellulosum
,
Magnesii stearas
,
Alcohol polyvinylicus
,
Macrogolum 3350
,
Talcum
,
Titanii dioxidum (E171)
,
Natrium ionisatum
Informazione destinata ai pazienti
Informazione destinata ai pazienti approvata da Swissmedic
Roche Pharma (Schweiz) AG
Zelboraf viene impiegato per il trattamento dei pazienti con melanoma (cancro cutaneo di colore nero) non operabile o metastatico nel caso in cui nel tumore sia stata dimostrata una specifica modificazione del patrimonio genetico (mutazione genica) (positività alla mutazione del gene BRAF V600). In molti melanomi e anche in altri tipi di tumore è presente una modificazione del gene BRAF. Questa mutazione dà origine a una crescita cellulare incontrollata e quindi al cancro. Zelboraf contiene il principio attivo vemurafenib, che inibisce le conseguenze della mutazione e quindi impedisce la crescita delle cellule cancerose.
Su prescrizione medica.
Qualora nel tumore non sia stata dimostrata questa specifica mutazione genica (assenza di positività alla mutazione del gene BRAF V600), i pazienti non dovranno essere trattati con Zelboraf.
Non deve assumere Zelboraf se è ipersensibile (allergico) verso il principio attivo vemurafenib o verso un altro degli ulteriori componenti di Zelboraf.
Informi il suo medico, se:
- ha problemi cardiaci. Il medico verificherà preventivamente se è possibile un trattamento con Zelboraf. Qualora, durante il trattamento, dovessero presentarsi un rallentamento o delle irregolarità del battito cardiaco, dovrà informarne immediatamente il medico.
- ha problemi con la funzione del fegato. Il medico verificherà preventivamente e durante il trattamento la funzione epatica.
- se ha problemi con la funzione dei reni. Sono stati riportati casi di compromissione della funzionalità renale con l'assunzione di Zelboraf. Il medico controllerà la funzione dei reni prima e durante il trattamento.
- soffre o ha sofferto di un'altra malattia cancerosa preesistente o passata.
Prima e durante il trattamento con Zelboraf è necessario un regolare controllo della pelle:
- se durante il trattamento con Zelboraf dovesse osservare delle alterazioni cutanee (anche eruzioni o una sensibilità alla luce), dovrà informarne quanto prima il medico.
- durante il trattamento, e fino a 6 mesi dopo l'ultima assunzione di Zelboraf, il suo medico le controllerà la pelle per verificare l'eventuale presenza di un carcinoma a cellule squamose (una forma speciale di cancro cutaneo). Di solito, esso si manifesta prevalentemente nella pelle danneggiata dal sole, resta confinato localmente e può essere trattato con una rimozione chirurgica.
- gravi reazioni cutanee: durante l'assunzione di Zelboraf possono insorgere gravi reazioni cutanee. Se sviluppa un'eruzione cutanea con uno dei seguenti sintomi, interrompa il trattamento con Zelboraf e consulti immediatamente il suo medico: vesciche sulla pelle, vesciche o piaghe in bocca, desquamazione della pelle, febbre, arrossamento o gonfiore del viso, delle mani o delle piante dei piedi.
Protezione solare durante il trattamento con Zelboraf:
- l'assunzione di Zelboraf può notevolmente incrementare la sensibilità della pelle alla luce solare o alle scottature solari. Per questo motivo, durante il trattamento è consigliabile evitare l'esposizione alla luce solare diretta.
- quando sarà costretto ad esporsi ai raggi solari, dovrà indossare degli indumenti adeguati, in modo tale da proteggere le braccia, le gambe, come anche la testa e il viso. In più è necessario applicare una crema solare ad ampio spettro UVA/UVB e un prodotto per le labbra contro il sole (entrambi con un fattore di protezione oltre 30).
- protegga la sua pelle fino a 5 giorni dopo l'ultima assunzione di Zelboraf, per ridurre il rischio di contrarre una scottatura solare.
Aggravamento della intolleranza alla terapia radiante:
Quando lei necessita di una terapia radiante, Zelboraf va usato con prudenza, poiché l'intolleranza alla terapia radiante può aggravarsi. Nella maggior parte dei casi era coinvolta la pelle, ma talora venivano coinvolti anche organi interni con esito letale.
Reazioni allergiche:
Durante l'assunzione di Zelboraf possono insorgere reazioni allergiche potenzialmente gravi. Se nota i sintomi di una reazione allergica, quali gonfiore del viso, delle labbra o della lingua, disturbi respiratori, eruzione cutanea o sensazione di svenimento, interrompa l'assunzione di Zelboraf e consulti immediatamente un medico.
Reazioni nell'occhio:
Sono state riportate gravi reazioni nell'occhio, compresa infiammazione della tunica media dell'occhio (uveite), nei pazienti che assumevano Zelboraf. Pertanto, il suo medico controllerà periodicamente i suoi occhi. Se dovesse percepire reazioni all'occhio, ne informi il suo medico.
Malattie della muscolatura scheletrica, del tessuto connettivo e delle ossa:
Informi il suo medico se constata un ispessimento anomalo dei palmi delle mani, con sensazione di trazione sulle dita rivolta verso l'interno, oppure un ispessimento insolito delle piante dei piedi o un incurvamento non naturale del suo pene, che possono provocare dolore.
Interazioni con altri medicamenti e con alimenti
L'assunzione concomitante di altri medicamenti (p.es. medicamenti per la terapia delle depressioni, medicamenti per la terapia delle aritmie cardiache, medicamenti per la terapia delle crisi epilettiche, antibiotici, medicamenti contro le infezioni da funghi, medicamenti contro l'HIV, medicamenti contro il vomito e la nausea, medicamenti anticoagulanti ecc.) può accelerare o ritardare la degradazione di Zelboraf nell'organismo. Se sta assumendo uno di questi medicamenti, probabilmente il suo medico lo sostituirà con un altro o ridurrà la dose di Zelboraf.
Per lo stesso motivo va ridotto il consumo di caffè, tè e cioccolata durante il trattamento con Zelboraf.
Zelboraf può rafforzare l'effetto di medicamenti contro l'insufficienza cardiaca e le aritmie cardiache. Se ha problemi di cuore, consulti il suo medico prima di assumere Zelboraf.
Capacità di condurre un veicolo e di utilizzare attrezzi o macchine:
Questo medicamento può ridurre la capacità di reazione, la capacità di condurre un veicolo e la capacità di utilizzare attrezzi o macchine!
Poiché Zelboraf può causare effetti collaterali quali vertigini stanchezza e problemi agli occhi, occorre prudenza durante la conduzione di veicoli e durante l'utilizzo di macchine.
Informi il suo medico o il suo farmacista nel caso in cui
- soffre di altre malattie
- soffre di allergie o
- assume altri medicamenti (anche se acquistati di sua iniziativa) o li applica esternamente.
Sodio
Questo medicamento contiene meno di 1 mmol (23 mg) di sodio compressa, cioè essenzialmente «senza sodio».
Durante il suo trattamento con Zelboraf dovrà evitare una gravidanza. Le donne in età fertile, durante il trattamento e almeno per sei mesi dopo l'assunzione dell'ultima compressa rivestita con film, dovranno adottare un metodo contraccettivo adeguato. Ciò vale anche per gli uomini.
Zelboraf può ridurre l'efficacia di alcuni contraccettivi che si assumono per via orale («pillola»). Informi il suo medico se assume contraccettivi orali.
Se durante il trattamento con Zelboraf dovesse rimanere incinta, informi immediatamente il suo medico che deciderà se dovrà proseguire il trattamento, poiché Zelboraf può nuocere al feto.
Durante il trattamento con Zelboraf dovrà rinunciare ad allattare.
La dose abituale nei pazienti adulti è di quattro compresse rivestite con film, due volte al giorno (complessivamente 8 compresse rivestite con film al giorno). La prima dose di 4 compresse rivestite con film dovrà essere assunta al mattino. La seconda dose di 4 compresse rivestite con film dovrà essere assunta alla sera, all'incirca 12 ore dopo la prima dose. Entrambe le dosi dovranno essere assunte o un'ora prima o due ore dopo il pasto.
Zelboraf compresse rivestite con film vanno ingerite intere, con un bicchiere d'acqua. Zelboraf compresse rivestite con film non devono essere né masticate né schiacciate.
In determinati casi, il medico potrà ridurre la dose (p.es. alla comparsa di effetti collaterali, vedi anche la rubrica «Quando è richiesta prudenza nella somministrazione di Zelboraf?»).
Nel caso avesse assunto una quantità maggiore di Zelboraf di quanto avrebbe dovuto
Informi immediatamente il suo medico o il suo farmacista.
Potrebbero comparire effetti collaterali più intensi del solito, e il medico eventualmente potrà interrompere il suo trattamento con Zelboraf.
Nel caso avesse dimenticato l'assunzione di Zelboraf
- Se avesse dimenticato l'assunzione di una dose, potrà recuperare l'assunzione della dose dimenticata fino a 4 ore prima della successiva assunzione programmata.
- Qualora fino alla successiva dose programmata restassero soltanto 4 ore o meno, occorrerà tralasciare la dose dimenticata e assumere la successiva dose al momento previsto.
- Non assuma una dose doppia per riequilibrare la dose dimenticata.
Se dopo l'assunzione di una dose di Zelboraf avesse presentato vomito
In caso di vomito dopo l'assunzione di Zelboraf non si consiglia di assumere un'ulteriore dose di Zelboraf, ma di proseguire la terapia come di consueto.
È importante che lei assuma Zelboraf tutti i giorni e per tutto il tempo prescritto dal medico. Non modifichi di propria iniziativa la posologia prescritta. Se ritiene che l'azione del medicamento sia troppo debole o troppo forte ne parli al suo medico o al suo farmacista.
L'uso e la sicurezza di Zelboraf nei bambini e negli adolescenti sotto i 18 anni finora non sono stati esaminati. Zelboraf non è omologato per l'uso in pazienti di età inferiore ai 18 anni.
Come tutti i medicamenti, anche questo medicamento può avere effetti collaterali, che tuttavia non compaiono necessariamente in ogni paziente.
Gravi reazioni allergiche
Se sviluppa una delle seguenti reazioni:
- gonfiore del viso, delle labbra o della lingua
- disturbi respiratori
- eruzione cutanea
- sensazione di svenimento
consulti immediatamente un medico. Non usi più Zelboraf finché non ha parlato con un medico.
Nei pazienti sottoposti a radioterapia prima, durante o subito dopo il trattamento con Zelboraf, può verificarsi un peggioramento degli effetti collaterali della radioterapia. Questi possono insorgere nell'area della regione irradiata, p. es. della pelle, dell'esofago, della vescica, del fegato, del retto e dei polmoni. Informi immediatamente il suo medico se manifesta uno dei seguenti sintomi:
- eruzione cutanea, formazione di vesciche, distacco della pelle o alterazione del colore della pelle
- fiato corto, che può essere accompagnato da tosse, febbre o brividi (polmonite)
- difficoltà a deglutire o dolore durante la deglutizione, dolore toracico, bruciore di stomaco o reflusso acido (infiammazione dell'esofago).
Se nota alterazioni di qualsiasi tipo a carico della pelle, consulti al più presto il suo medico.
Gli effetti collaterali elencati sono suddivisi per frequenza.
Molto comune (riguarda più di 1 persona su 10)
- dolori articolari
- stanchezza
- eruzione cutanea
- aumentata sensibilità alla luce solare
- nausea
- perdita dei capelli
- problemi cutanei, incluse verruche
- vomito
- prurito
- diarrea
- mal di testa
- pelle squamosa
- dolori muscolari
- gonfiore, solitamente delle braccia e/o delle gambe (edema periferico)
- un determinato tipo di cancro della pelle (carcinoma cutaneo a cellule squamose)
- riduzione / perdita dell'appetito
- pelle secca
- febbre
- stitichezza
- tosse
- alterazione dei valori epatici (aumento della γ-GT)
- eritema solare
- arrossamento della pelle
- mal di schiena
- dolori all'apparato locomotore
- infiammazione della radice dei peli (follicolite)
- perdita di peso
- alterazione del senso del gusto
- problemi ai nervi che possono causare dolore, perdita della sensibilità e/o debolezza muscolare (neuropatia periferica) o una sensazione di formicolio o bruciore alle mani e ai piedi
- sindrome mano-piede (ossia arrossamento, desquamazione della pelle o vesciche sulle mani e sui piedi)
- dolori alle braccia e alle gambe
- infiammazione delle articolazioni (artrite)
- vertigini
Comune (riguarda da 1 a 10 persone su 100)
- alcuni tipi di cancro della pelle (basalioma, cheratoacantoma, nuovi melanomi primari)
- debolezza o fiacchezza (astenia)
- ispessimento del tessuto sotto i palmi delle mani, che può portare a un'incurvatura delle dita verso l'interno e, in casi gravi, a disabilità
- infiammazione degli occhi (uveite e iridociclite)
- paralisi di Bell (una forma di paralisi facciale)
- infiammazione dei vasi sanguigni
- alterazione dei valori epatici (aumento dell'ALT, della fosfatasi alcalina e della bilirubina)
- alterazioni dell'attività elettrica del cuore (prolungamento del QT)
- infiammazione del tessuto sottocutaneo
Non comune (riguarda da 1 a 10 persone su 1000)
- infiammazione del pancreas
- alterazione dei valori di laboratorio relativi al fegato o danni epatici, inclusi gravi danni epatici che possono compromettere la capacità del fegato di svolgere pienamente le sue funzioni
- un tipo di cancro (carcinoma non cutaneo a cellule squamose [non-cuSCC])
- ispessimento dei tessuti profondi sotto la pianta del piede, che in casi gravi può portare a disabilità
- disturbo della circolazione del sangue in una parte dell'occhio (occlusione venosa retinica)
- riduzione del numero di globuli bianchi (neutropenia)
- gravi reazioni cutanee con formazione di vesciche, febbre e distacco della pelle
Raro (riguarda da 1 a 10 persone su 10 000)
- Malattia infiammatoria che colpisce prevalentemente la pelle, i polmoni e gli occhi (sarcoidosi)
Molto raro (riguarda meno di 1 persona su 10 000)
- reazioni di ipersensibilità / reazioni allergiche che possono provocare gonfiore del viso e disturbi respiratori
Singoli casi
Dopo la commercializzazione sono stati riportati casi isolati di aggravamento di una leucemia preesistente e di reazioni infiammatorie con alterazioni a carico dei globuli bianchi e di aggravamento di un carcinoma pancreatico preesistente. Inoltre, sono stati osservati casi isolati di reazioni di ipersensibilità con eruzione cutanea da medicamenti, febbre e aumento del numero di globuli bianchi.
Sono stati riportati casi di leggera compromissione della funzionalità renale fino a lesioni acute dei reni.
Se osserva effetti collaterali, si rivolga al suo medico, farmacista, soprattutto se si tratta di effetti collaterali non descritti in questo foglietto illustrativo.
Il medicamento non dev'essere utilizzato oltre la data indicata con «EXP» sul contenitore.
Indicazione di stoccaggio
Non conservare a temperature superiori a 30 °C.
Conservare il contenitore nella scatola originale per proteggere il contenuto dall'umidità.
Conservare fuori dalla portata dei bambini.
Ulteriori indicazioni
I medicamenti non utilizzati devono essere smaltiti appropriatamente.
Il medico o il farmacista, che sono in possesso di un'informazione professionale dettagliata, possono darle ulteriori informazioni.
Principi attivi
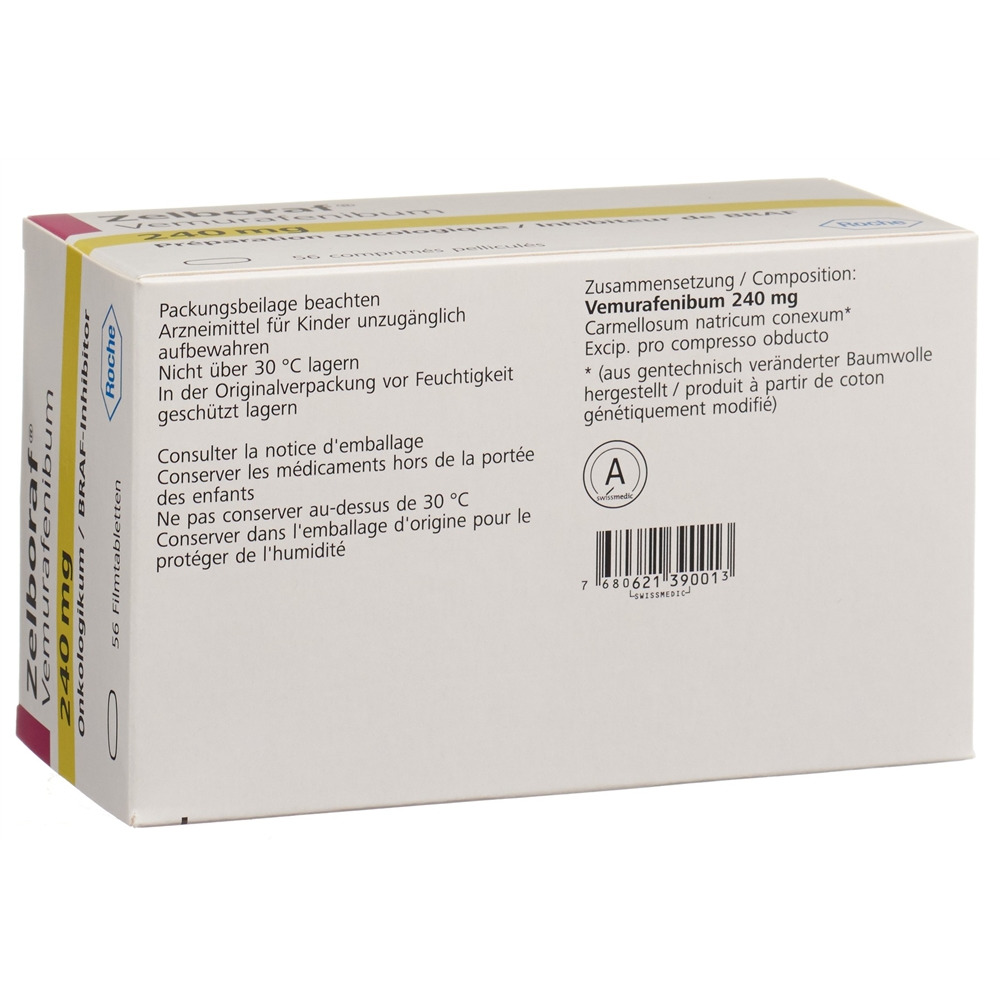
Una compressa rivestita con film contiene come principio attivo 240 mg di vemurafenib.
Sostanze ausiliarie
Nucleo della compressa
Ipromellosa acetato succinato, biossido di silicio colloidale, croscarmellosa sodica (prodotta da cotone geneticamente modificato), idrossipropilcellulosa, stearato di magnesio.
Pellicola di rivestimento
Alcool polivinilico, ossido di titanio IV, macrogol 3350, talco, ossido di ferro (III).
62139 (Swissmedic).
In farmacia dietro presentazione della prescrizione medica non rinnovabile.
Compresse rivestite con film da 240 mg: 56.
Roche Pharma (Svizzera) SA, Basilea.
Questo foglietto illustrativo è stato controllato l'ultima volta nel maggio 2025 dall'autorità competente in materia di medicamenti (Swissmedic).
Numero di articolo
5046998